马上注册,学习空分知识,结交更多空分大神!
您需要 登录 才可以下载或查看,没有账号?加入空分之家
x
三、热力学第二定律 熵6 O8 X6 H) B9 B F# ^: }+ [
1、热力学第二定律
% u& ~4 j0 L7 \" n; j0 d+ r; T 克劳修斯于1850年提出了完整的热力学第二定律:热不可能自发的、不付代价的从一个低温物体传给另一个高温物体。
) E+ U" F- E6 i7 d, e+ x 如上所述,热能从低温传向高温的过程或热能转化为机械能的过程是不会自发进行的,要使它们成为可能,必须同时有其他一些过程,如机械能转化为热能的过程,或热能从高温传向低温的过程,或工质膨胀的过程同时进行,前面一些过程的进行必须有自发过程的同时进行为其条件。
, F. h! C, z; g6 k& _+ Y0 [& f' M 2、熵1 g) G5 k9 z; K/ O# Q' Z* ~+ z
熵与温度、压力、比体积、内能、焓一样,也是一个状态参数。
0 v. j, j( p+ k" w0 Z" v* J 自然界许多现象都有方向性,即向某一方向可以自发地进行,反之,则不能。热量只能从高温物体传给低温物体;高压气体会自发地向低压方向膨胀·······它们的逆过程不能自发进行。这种有方向性的过程,我们称之为“不可逆过程”。
0 X$ Z e! Q7 V2 u 不可逆过程前后的两个状态是不能价的,但是用什么量能说明它们的不等价性呢?' U( l: X# x8 F5 l8 y1 i
理论和实践证明,熵可以用来度量不可逆过程前后两个状态的不等价性。8 x/ p C' A4 ^* W
如图1-1所示,如果空气通过节流阀和膨胀机时,压力均从P1降到P2,在理想情况下,两个过程均看成是绝热过程。但是由于节流过程没有对外做功,压力降完全消耗在节流阀的摩擦、涡流及气体撞击损失上。要使气流自发地从压力低处P2返向压力高处P1是不可能的,因此它是一个不可逆过程。对膨胀机而言,膨胀机叶轮对外做功,使气体的压力降低,内部能量减少,在理论情况下,如果将所有做出的功用压缩机加以回收,则仍可以将气体由P2压缩至P1,不必消耗外界的能量。因此,膨胀机的理想绝热膨胀过程是一个可逆过程。1 `* e# T- g) d; T# v* a Q
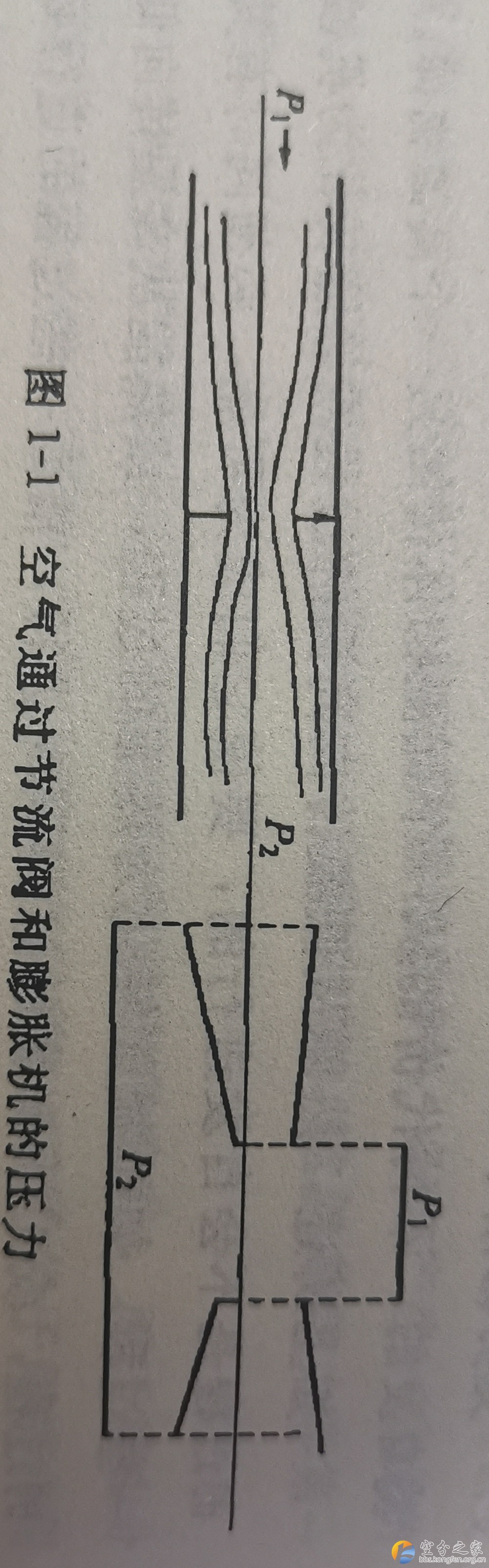
2 Q" U* l6 W5 B# P6 S2 y 由此可见,节流和膨胀后的压力虽然相同。但是这两个状态是不等价的,它们的不等价性通过理论证明可用熵来度量,对节流过程来说,是绝热的不可逆过程,熵是增大的;对膨胀机来说,在理想情况下是一可逆过程,熵不变,即节流后的熵值比膨胀后的熵要大。其差值说明了不可逆的程度。
7 j* e |- h9 D* y: O8 X 对其他绝热过程来说,自发过程总是朝着熵增大的方向进行。因此,熵就是表示过程方向性的一个状态参数。
2 v( A3 N2 T8 \# ~5 r/ Q 熵的定义式为: dS=aP/T 或 ΔS=q/T, a4 v% W6 D8 U P0 d L5 s1 l
熵的增量等于系统在可逆过程中从外界传入的热量除以传热当时的绝对温度所得的商。
; o/ R5 ~% L% o 从熵的定义式看出,dS=0或ΔS=0表示绝热;ΔS>0表示过程吸热;ΔS<0表示过程放热,而工程热力学中又规定向工质传入热量为正,从工质对外传出热量为负。
% b9 Q2 v) V7 J5 a. z# E) j3 F6 }5 J; i
# p+ m' k" _* I! q9 r+ c, k4 P3 K" n: i4 z
下一期:第五节 空气的液化 |
|